Исследование эффективности и безопасности применения инъекционной формы комплекса стабилизированной и нативной гиалуроновой кислоты и сорбитола для гидратации кожи губ пациентов, принимающих системные ретиноиды
Изотретиноин — ретиноид, одобренный Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) в 1982 г. для лечения тяжелых и стойких угревых высыпаний [1]. Изотретиноин является единственным лекарственным средством, способным воздействовать на все четыре патогенетических механизма акне: гиперсеборею, гиперкератоз, колонизацию Cutibacterium acnes и воспаление [1]. В случае тяжелых или среднетяжелых форм узловато-кистозных и папулезно-пустулезных угрей пероральный прием изотретиноина часто назначается в качестве терапии первой линии [2, 3]. Последние европейские и американские клинические рекомендации включают назначение изотретиноина уже при акне средней тяжести, особенно если заболевание быстро рецидивирует после прекращения топического лечения [2, 4, 5].
Российские клинические рекомендации склоняются к назначению изотретиноина в основном в случае тяжелых форм заболевания, так как препарат потенциально тератогенен и обладает рядом побочных эффектов [3]. Наиболее распространенными побочными эффектами системного применения изотретиноина является сухость кожи и слизистых, реже возникают головная боль, алопеция, артралгии и миалгии, проблемы со сном. Тяжелые нежелательные явления (такие как депрессия или воспалительные заболевания кишечника) встречаются редко [5—8]. Несмотря на то что сухость кожи и слизистых — это предсказуемый, контролируемый и полностью обратимый побочный эффект терапии изотретиноином, он может доставлять определенные неудобства пациентам. Выраженная сухость губ с появлением корок и болезненных трещин встречается у 90—100% пациентов, принимающих системные ретиноиды [5].
В некоторых случаях эти побочные эффекты доставляют значительный дискомфорт и настолько тяжело переносятся, что приводят к некомплаентности или даже отказу от лечения [9]. Коррекция и профилактика данных нежелательных явлений является ключом к успеху терапии акне системными препаратами изотретиноина [10]. Цель исследования — определение эффективности и безопасности применения инъекционной формы частично-перекрестно-связанной (смеси нативной и стабилизированной) гиалуроновой кислоты и сорбитола для уменьшения проявлений сухости губ на фоне применения изотретиноина.
Материал и методы
В исследовании приняли участие 10 женщин в возрасте 20—30 лет (средний возраст 26±3,2 года), принимающих изотретиноин для лечения акне. Назначение изотретиноина проводилось врачом дерматологом после осмотра и обследования, все пациентки были проинформированы о побочных эффектах изотретиноина и необходимости контрацепции на период лечения.
На момент включения пациенток в исследование они находились на разных этапах курса лечения изотретиноином в дозах 0,3—1,15 мг/кг (в большинстве случаев 0,5—0,9 мг/кг). Все пациентки предъявляли жалобы на выраженную сухость губ, сопровождающуюся образованием трещин и корок, причем наружные средства (бальзамы и смягчающие препараты) не купировали дискомфорт полностью. Также пациентки обращали внимание на то, что из-за шелушения и сильной складчатости губ они не могут использовать декоративную губную помаду. Для клинической оценки тяжести ретиноидного хейлита J. Ornelas и соавт. [11] предложена клиническая шкала, учитывающая различную степень выраженности основных его признаков (таблица).
В исследовании приняли участие 10 женщин в возрасте 20—30 лет (средний возраст 26±3,2 года), принимающих изотретиноин для лечения акне. Назначение изотретиноина проводилось врачом дерматологом после осмотра и обследования, все пациентки были проинформированы о побочных эффектах изотретиноина и необходимости контрацепции на период лечения. На момент включения пациенток в исследование они находились на разных этапах курса лечения изотретиноином в дозах 0,3—1,15 мг/кг (в большинстве случаев 0,5—0,9 мг/кг).
Все пациентки предъявляли жалобы на выраженную сухость губ, сопровождающуюся образованием трещин и корок, причем наружные средства (бальзамы и смягчающие препараты) не купировали дискомфорт полностью. Также пациентки обращали внимание на то, что из-за шелушения и сильной складчатости губ они не могут использовать декоративную губную помаду. Для клинической оценки тяжести ретиноидного хейлита J. Ornelas и соавт. [11] предложена клиническая шкала, учитывающая различную степень выраженности основных его признаков (таблица).
Таблица. Шкала оценки степени выраженности хейлита, ассоциированного с ретиноидами, по Ornelas
По шкале Ornelas степень тяжести хейлита у пациенток при включении в исследование составила в среднем 6±1,6 балла. После осмотра и процедуры подписания протокола информированного добровольного согласия проводили в области красной каймы губ однократную инъекцию дермального имплантата, содержащего смесь нативной и стабилизированной гиалуроновой кислоты (12,5 мг/мл), а также сорбитол в объеме 1 мл (Stylage HydroMax, Vivacy Laboratoires, Франция, ФСЗ 2009/03607).
Техника введения подбиралась индивидуально в зависимости от анатомических особенностей и потребностей пациента. По условиям исследования пациентки должны были придерживаться привычного наружного ухода за зоной губ. Также им было рекомендовано избегать прямых солнечных лучей и использовать солнцезащитные средства с высоким солнцезащитным фактором (Sun Protection Factor — SPF), особенно в зоне повреждения кожи. Контроль состояния губ проводили при первом визите (до проведения процедуры), а также через 2 нед и 4 нед после процедуры.
Методы контроля включали осмотр с определением степени тяжести хейлита, фотографирование в высоком разрешении (в одной проекции) при каждом осмотре, а также заполнение опросника общего эстетического улучшения (Global Aesthetic Improvement Scale — GAIS) врачом и пациентками. Оценку общей удовлетворенности результатом по 5-балльной шкале GAIS (–1 — стало хуже; 0 — отсутствие эффекта; 2 — результат заметен, но он неудовлетворительный; 4 — удовлетворительный результат; 5 — отличный результат, отвечающий ожиданиям) проводили через 2 нед и в конце исследования (через 4 нед после процедуры).
Также пациентки заполняли опросник ДИКЖ (дерматологический индекс качества жизни) на каждом визите, при этом их просили оценивать влияние сухости губ и хейлита, а не основного заболевания. Контроль нежелательных явлений проводился на всех этапах исследования.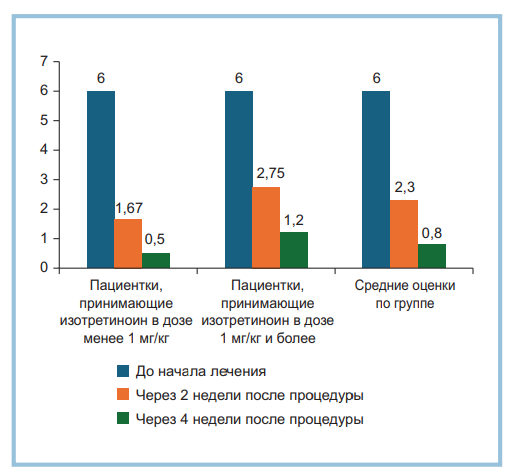
Рис. 1. Динамика оценки тяжести хейлита по шкале Ornelas, баллы (n=10).
Результаты
После инъекций препарата гиалуроновой кислоты клиническая оценка тяжести хейлита уменьшилась с 6±1,6 балла до 2,3±0,74 балла через 2 нед и до 0,8±0,8 балла через 4 нед (рис. 1). При этом пациентки, принимающие изотретиноин в дозировке до 1 мг, демонстрировали несколько более быстрое и значительное снижение показателей по шкале Ornelas (1,67±0,77 балла через 2 нед и 0,5±0,77 балла через 4 нед после процедуры) по сравнению с пациентками, принимающими изотретиноин в более высоких дозах (2,75±0,75 балла через 2 нед и 1,2±0,5 балла через 4 нед после процедуры) при одинаковой исходной оценке тяжести хейлита.
Помимо субъективного уменьшения сухости и количества трещин в области красной каймы и комиссур, разрешения корочек пациентки отмечали значительное эстетическое улучшение: инъекция не меняла привычные объем и форму губ, но позволяла разгладить мелкие складки и морщины, губы выглядели более гладкими и визуально привлекательными. 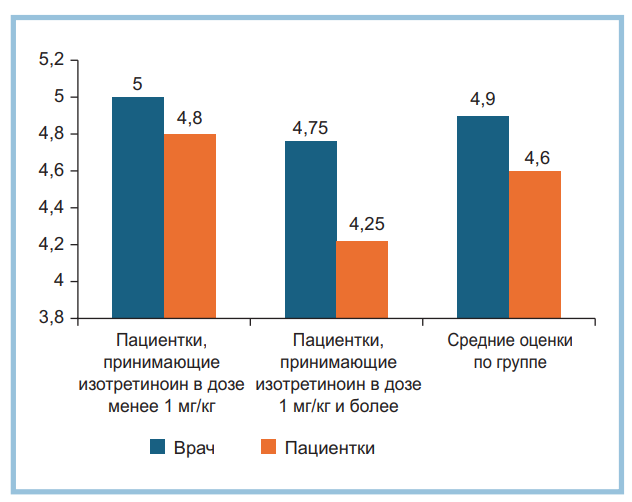
Рис. 2. Оценка общей удовлетворенности врача и пациенток результатами лечения по шкале GAIS через 4 нед после процедуры, баллы (n=10).
Пациентки продолжали использование наружных ухаживающих средств, но в меньшем объеме. Улучшение качества кожи губ позволило женщинам, ранее использовавшим декоративную косметику для губ, вернуться к ее применению. Отмечена высокая удовлетворенность как врача, так и пациенток результатами лечения. Средний балл по опроснику GAIS составил 4,9±0,18 балла по мнению врача и 4,6±0,56 балла по мнению пациенток (что соответствует оценкам «удовлетворен» или «полностью удовлетворен») (рис. 2).
При этом выявлена обратная корреляция между дозой изотретиноина и уровнем удовлетворенности. Пациентки, принимающие изотретиноин в дозе до 1 мг/кг, демонстрировали более высокий уровень удовлетворенности (5 баллов по оценке врача и 4,8±0,27 балла по оценке пациенток), тогда как пациентки, принимающие препарат в дозе 1 мг/кг и более, были удовлетворены результатом в несколько меньшей степени (4,75±0,38 балла по мнению врача и 4,25±0,75 балла по мнению пациенток).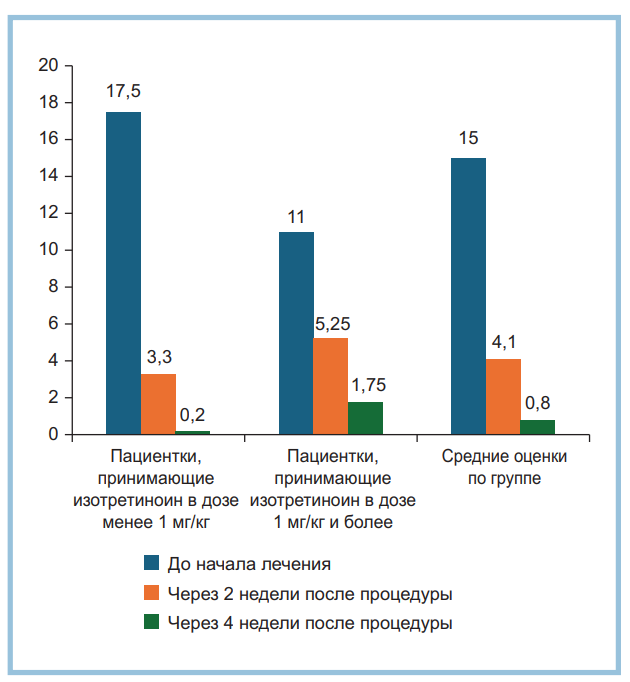
Рис. 3. Динамика оценки по опроснику ДИКЖ (дерматологический индекс качества жизни), баллы (n=10).
По данным опросника ДИКЖ, наблюдалось весьма значительное улучшение качества жизни пациенток (рис. 3). До начала исследования оценка по опроснику ДИКЖ составляла 15±4,4 балла, что соответствует выраженному влиянию хейлита на качество жизни. Через 2 нед после введения препарата индекс составлял 4,1±3,2 балла (незначительное влияние хейлита на качество жизни), через 4 нед — 0,8±0,96 балла (отсутствие влияния хейлита на качество жизни). При этом также была выявлена обратная корреляция с назначенной дозой изотретиноина.
Пациентки, принимающие изотретиноин в дозе менее 1 мг/кг, изначально демонстрировали высокие оценки по шкале ДИКЖ (17±2,8 балла и выше), но после процедуры индекс снижался быстро и выраженно (3,3±2,8 балла через 2 нед и 0,2±0,3 балла через 4 нед). Тогда как пациентки, принимающие изотретиноин в более высоких дозах, изначально оценивали свое состояние в 11±4,4 балла. Возможно, их беспокойство в основном было связано с основным заболеванием. После процедуры снижение индекса у них было более медленным и менее выраженным (5,25±2,6 балла через 2 нед и 1,75±1,25 балла через 4 нед). Автор предполагает, что повторное проведение процедуры (или введение большего объема препарата при первой процедуре) позволило бы нивелировать различия между показателями удовле творенности и ДИКЖ между группами.
Фотографии (в динамике) пациенток, участвовавших в исследовании, представлены на рис. 4—7. Выявленные в ходе исследования нежелательные явления были связаны с проведенной инъекционной процедурой (незначительные кровоизлияния и отечность в зоне губ) и разрешались самостоятельно в течение нескольких дней. В целом пациентки хорошо переносили как саму процедуру, так и период реабилитации, что может свидетельствовать о безопасности применения препарата даже у пациентов, находящихся на терапии системными ретиноидами.
Обсуждение
Хейлит — дозозависимое и прогнозируемое нежелательное явление при терапии пероральными ретиноидами, которое, по сути, является маркером адекватного подбора дозировки и соблюдения режима применения [12].
Обычно первые признаки сухости губ возникают уже на 7-й день от начала терапии, и отсутствие хейлита должно насторожить лечащего врача в плане вероятной некомплаентности пациента и нарушения им рекомендаций [10, 13]. Однако выраженная сухость неизбежно беспокоит пациента и значительно снижает качество его жизни.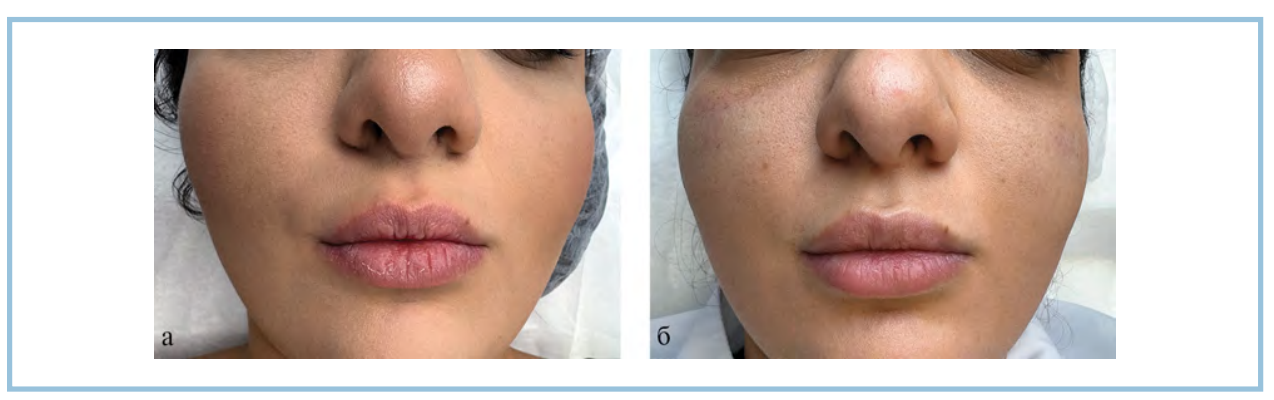 Рис. 4. Пациентка 1, изотретиноин в дозе 0,8 мг/кг. Клиническая картина области красной каймы губ до начала лечения (а) и через 4 нед после проведенных инъекций (б).
Рис. 4. Пациентка 1, изотретиноин в дозе 0,8 мг/кг. Клиническая картина области красной каймы губ до начала лечения (а) и через 4 нед после проведенных инъекций (б).
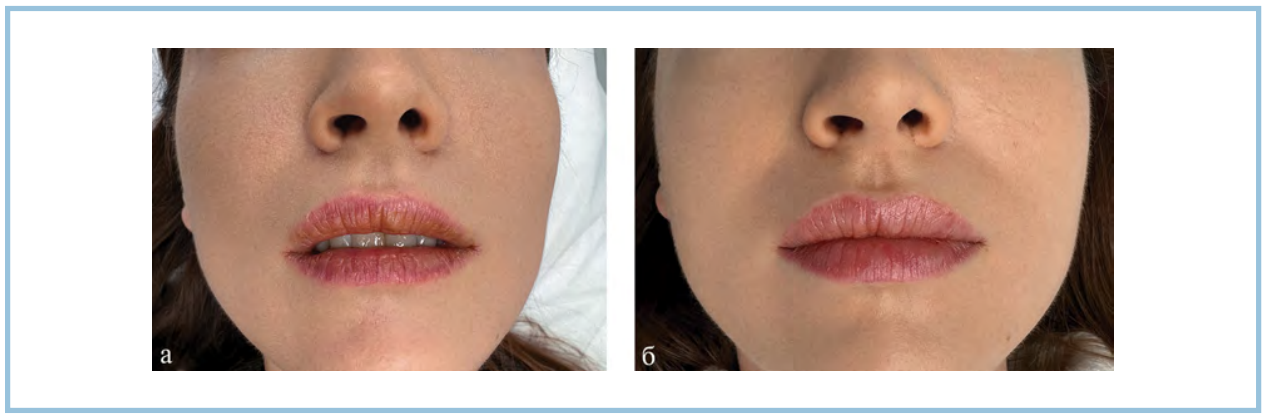 Рис. 5. Пациентка 2, изотретиноин в дозе 1,15 мг/кг. Клиническая картина области красной каймы губ до начала лечения (а) и через 4 нед после проведенных инъекций (б).
Рис. 5. Пациентка 2, изотретиноин в дозе 1,15 мг/кг. Клиническая картина области красной каймы губ до начала лечения (а) и через 4 нед после проведенных инъекций (б).
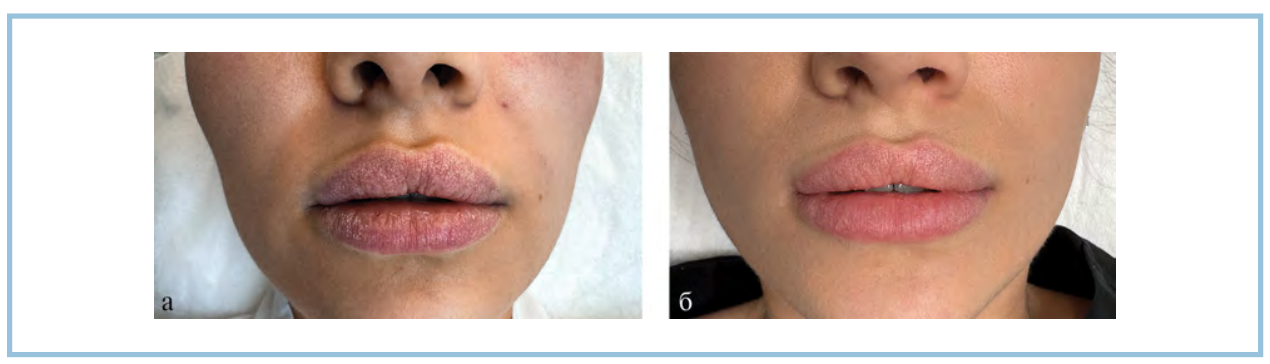 Рис. 6. Пациентка 3, изотретиноин в дозе 0,8 мг/кг. Клиническая картина области красной каймы губ до начала лечения (а) и через 4 нед после проведенных инъекций (б).
Рис. 6. Пациентка 3, изотретиноин в дозе 0,8 мг/кг. Клиническая картина области красной каймы губ до начала лечения (а) и через 4 нед после проведенных инъекций (б).
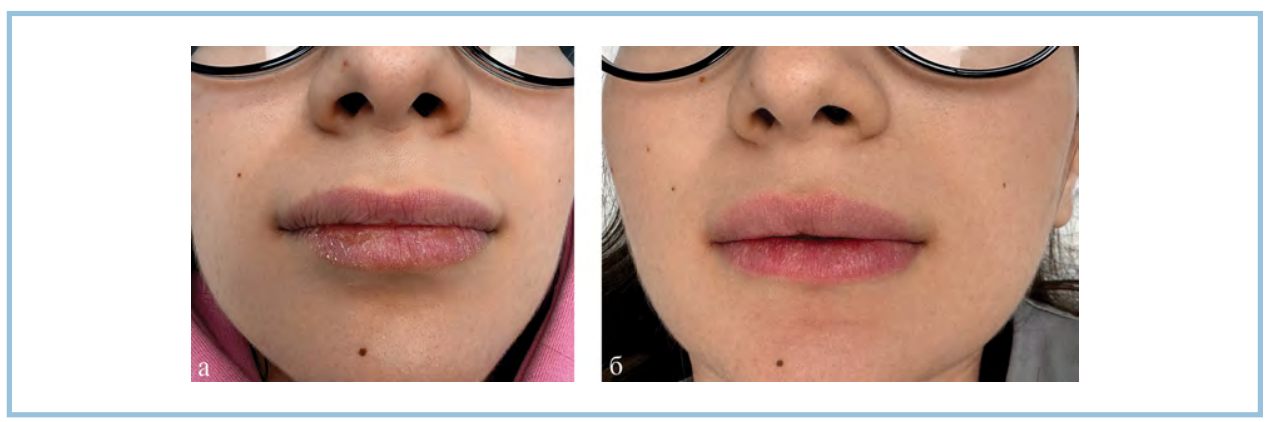 Рис. 7. Пациентка 4, изотретиноин в дозе 0,3 мг/кг. Клиническая картина области красной каймы губ до начала лечения (а) и через 4 нед после проведенных инъекций (б).
Рис. 7. Пациентка 4, изотретиноин в дозе 0,3 мг/кг. Клиническая картина области красной каймы губ до начала лечения (а) и через 4 нед после проведенных инъекций (б).
Тяжелый хейлит с формированием трещин и корочек может приводить к затруднению мимики, приема пищи и артикуляции [13]. На сегодняшний день пациентам с хейлитом, индуцированным приемом ретиноидов, чаще всего назначают смягчающие и увлажняющие губы наружные средства (бальзамы или гигиеническую помаду) [10, 12, 14—16]. Описан позитивный эффект средств для губ с содержанием стероидов для контроля воспаления [17].
Такие меры в достаточной степени эффективны, но не всегда способны полностью устранить симптоматику. В нескольких исследованиях продемонстрирован положительный эффект при пероральном приеме препаратов омега-3-полиненасыщенных жирных кислот [16, 18, 19]. Некоторые авторы предполагают, что комплексные биодобавки с содержанием антиоксидантов могут давать некоторое улучшение, однако эти данные противоречивы [16].
Ограниченный положительный опыт касается применения инъекционной формы декспантенола для мезотерапии области красной каймы губ при их сильной сухости в результате приема изотретиноина [20, 21]. Российские авторы имеют позитивный опыт проведения аутоплазмотерапии [22]. Мезотерапия и биоревитализация препаратами на основе гиалуроновой кислоты активно применяются для улучшения внешнего вида и оздоровления кожи. При использовании для ревитализации инъекционных форм высокомолекулярной нативной и стабилизированной гиалуроновой кислоты отмечается пролонгированная гидратация кожи [23—25].
Клинические наблюдения за пациентами показывают, что на фоне проведения биоревитализации губ или введения препаратов, содержащих комплекс стабилизированной и нативной гиалуроновой кислоты, с целью коррекции формы и объема губ разрешаются признаки эксфолиативного хейлита. Все это служит обоснованием для терапии хейлита, возникающего на фоне применения изотретиноина, путем инъекций препаратов гиалуроновой кислоты в область красной каймы губ.
Результаты настоящего исследования демонстрируют выраженное улучшение как внешнего вида, так и субъективных ощущений пациенток, а также их высокую удовлетворенность проведенным лечением. Инъекционный имплантат Stylage HydroMax содержит нативную и стабилизированную формы гиалуроновой кислоты, что является оптимальным для оказания немедленного увлажняющего действия и создания пролонгированного гидрорезерва.
Кроме того, высокомолекулярная нативная гиалуроновая кислота обладает выраженным противовоспалительным действием [26]. Сорбитол, в свою очередь, обеспечивает дополнительную гидратацию и антиоксидантный эффект [27]. После проведения инъекции пациентки отмечали достаточно быстрое достижение эффекта увлажнения губ. Ко второй неделе клиническая картина значительно улучшилась и сохранялась таковой на протяжении 4 нед наблюдения. Дальнейшее наблюдение за пациентками показало, что эффект частично сохраняется на протяжении 3 мес. На этом сроке можно рекомендовать повторную процедуру.
Заключение
Результаты исследования демонстрируют высокую эффективность и безопасность применения дермального имплантата на основе комплекса нативной и перекрестно-связанной гиалуроновой кислоты с сорбитолом для лечения хейлита, вызванного приемом пероральных ретиноидов. Использование опросника ДИКЖ (дерматологический индекс качества жизни) позволило выявить эффекты в отношении качества жизни, не связанные непосредственно с эстетикой губ.
Автор заявляет об отсутствии конфликта интересов. The author declares no conflicts of interest.
Литература
1. Li Y, Hu X, Dong G, Wang X, Liu T. Acne treatment: research progress and new perspectives. Front Med (Lausanne). 2024 July 10;11:1425675. PMID: 39050538; PMCID: PMC11266290. https://doi.org/10.3389/fmed.2024.1425675
2. Vallerand IA, Lewinson RT, Farris MS, Sibley CD, Ramien ML, Bulloch AGM, Patten SB. Efficacy and adverse events of oral isotretinoin for acne: a systematic review. British Journal of Dermatology. 2018 Jan;178(1):76-85. Epub 2017 Dec 08. PMID: 28542914.
3. Самцов А.В., Аравийская Е.Р. Федеральные клинические рекомендации по ведению больных акне. Российское общество дерматовенерологов и косметологов. Москва; 2015. Samtsov AV, Araviyskaya ER. Federal clinical guidelines for the management of acne patients. Russian Society of Dermatovenerologists and Cosmetologists. Moscow; 2015. (In Russ.).
4. Reynolds RV, Yeung H, Cheng CE, Cook-Bolden F, Desai SR, Druby KM, Freeman EE, Keri JE, Stein Gold LF, Tan JKL, Tollefson MM, Weiss JS, Wu PA, Zaenglein AL, Han JM, Barbieri JS. Guidelines of care for the management of acne vulgaris. J Am Acad Dermatol. 2024;90(5):1006.e1-1006.e30. https://doi.org/10.1016/j.jaad.2023.12.017
5. Bagatin E, Costa CS. The use of isotretinoin for acne — an update on optimal dosing, surveillance, and adverse effects. Expert Rev Clin Pharmacol. 2020;13(8):885-897. https://doi.org/10.1080/17512433.2020.1796637
6. Zaenglein AL, Pathy AL, Schlosser BJ, Alikhan A, Baldwin HE, Berson DS, Bowe WP, Graber EM, Harper JC, Kang S, Keri JE, Leyden JJ, Reynolds RV, Silverberg NB, Stein Gold LF, Tollefson MM, Weiss JS, Dolan NC, Sagan AA, Stern M, Boyer KM, Bhushan R. Guidelines of care for the management of acne vulgaris. J Am Acad Dermatol. 2016;74(5):945-973.e33. https://doi.org/10.1016/j.jaad.2015.12.037
7. Strauss JS, Krowchuk DP, Leyden JJ, Lucky AW, Shalita AR, Siegfried EC, Thiboutot DM, Van Voorhees AS, Beutner KA, Sieck CK, Bhushan R; American Academy of Dermatology/American Academy of Dermatology Association. Guidelines of care for acne vulgaris management. J Am Acad Dermatol. 2007;56(4):651-663. https://doi.org/10.1016/j.jaad.2006.08.048
8. Brzezinski P, Borowska K, Chiriac A, Smigielski J. Adverse effects of isotretinoin: A large, retrospective review. Dermatol Ther. 2017 July;30(4). Epub 2017 Mar 14. PMID: 28295859. https://doi.org/10.1111/dth.12483
9. Mirnezami M, Rahimi H. Is Oral Omega-3 Effective in Reducing Mucocutaneous Side Effects of Isotretinoin in Patients with Acne Vulgaris? Dermatol Res Pract. 2018;2018:6974045. https://doi.org/10.1155/2018/6974045
10. Park KY, Ko EJ, Kim IS, Li K, Kim BJ, Seo SJ, Kim MN, Hong CK. The effect of evening primrose oil for the prevention of xerotic cheilitis in acne patients being treated with isotretinoin: a pilot study. Ann Dermatol. 2014; 26(6):706-712. https://doi.org/10.5021/ad.2014.26.6.706
11. Ornelas J, Rosamilia L, Larsen L, Foolad N, Wang Q, Li CS, Sivamani RK. Objective assessment of isotretinoin-associated cheilitis: Isotretinoin Cheilitis Grading Scale. J Dermatolog Treat. 2016;27(2):153-155. https://doi.org/10.3109/09546634.2015.1086477
12. Перламутров Ю.Н., Ольховская К.Б. Клиническая эффективность и профиль безопасности системного изотретиноина в терапии акне. Клиническая дерматология и венерология. 2020;19(5):730-736. Perlamutrov YuN, Olkhovskaya KB. Clinical effectiveness and safety profile of systemic isotretinoin in acne therapy. Russian Journal of Clinical Dermatology and Venereology. 2020;19(5):730-736. (In Russ.). https://doi.org/10.17116/klinderma202019051730
13. Madke B, Shah H, Singh AL, Khoja M, Kabra P. Oral Retinoid-induced Cheilitis. Indian Journal of Drugs in Dermatology. 2016;2(1):50-53. https://doi.org/10.4103/2455-3972.184104
14. Mansouri P, Azizian Z, Hejazi S, Chalangari R, Chalangari KM. Evaluation the efficacy of trichloroacetic acid (TCA) 33% in treatment of oral retinoid-induced cheilitis compared with placebo (Vaseline): a randomized pilot study. J Dermatolog Treat. 2018;29(7):694-697. https://doi.org/10.1080/09546634.2018.1441489
15. Cassano N, De Benedittis M, Petruzzi M, et al. Topical Vitamin E Acetate for the Treatment of Cheilitis: A Multicentre Experience. European Journal of Inflammation. 2003;1(3):125-128. https://doi.org/10.1177/1721727X0300100306
16. Reyes-Hadsall S, Ju T, Keri JE. Use of Oral Supplements and Topical Adjuvants for Isotretinoin-Associated Side Effects: A Narrative Review. Skin Appendage Disord. 2024;10(1):1-9. https://doi.org/10.1159/000533963
17. Neill BC, Willis CD, Neill JA, Hanson C, Rajpara A, Aires DJ. Treating isotretinoin-associated cheilitis with hydrocortisone-containing lip balm. J Am Acad Dermatol. 2023;88(3):e113. https://doi.org/10.1016/j.jaad.2018.02.076
18. Круглова Л.С., Грязева Н.В., Таирова Н.А. Эффективность совместного приема системного изотретиноина и омега-3 у пациентов с акне. Эффективная фармакотерапия. 2024;20(28):62-66. Kruglova LS, Gryazeva NV, Tairova NA. The effectiveness of combined intake of systemic isotretinoin and omega-3 in patients with acne. Effective Pharmacotherapy. 2024;20(28):62-66. (In Russ.). https://doi.org/10.33978/2307-3586-2024-20-28-62-66
19. Zainab Z, Malik NA, Obaid S, Malik S, Aftab K, Mumtaz M, Pervez A, Syed Z. Effectiveness of Oral Omega 3 in Reducing Mucocutaneous Side Effects of Oral Isotretinoin in Patients with Acne Vulgaris. J Ayub Med Coll Abbottabad. 2021;33(1):60-63. PMID: 33774956.
20. Metin N, Karapınar T, Turan Ç. Lip mesotherapy with dexpanthenol in the treatment of isotretinoin-induced cheilitis. J Cosmet Dermatol. 2022;21(10): 4684-4690. https://doi.org/10.1111/jocd.14993
21. Turan Ç, Öner Ü. Lip Mesotherapy with Dexpanthenol as a Novel Approach to Prevent Isotretinoin-Associated Cheilitis. Dermatol Pract Concept. 2023; 13(1):e2023012. PMID: 36892384; PMCID: PMC9946106. https://doi.org/10.5826/dpc.1301a12
22. Казьмина И.Б., Кошель М.В., Сотникова А.Ю., Одинец А.В. Клинический случай медикаментозного хейлита на фоне приема системного изотретиноина. Вестник молодого ученого. 2021;10(1):20-22. Kazmina IB, Koshel MV, Sotnikova AYu, Odinets AV. A clinical case of medicinal cheilitis on the background of systemic isotretinoin administration. Bulletin of the Young Scientist. 2021;10(1):20-22. (In Russ.).
23. Kerscher M, Prager W, Fischer TC, Gauglitz GG, Pavicic T, Kühne U, Kravtsov M, Hofmann M, Dersch H, Sattler S. Facial Skin Revitalization with Cohesive Polydensified Matrix-HA20G: Results from a Randomized Multicenter Clinical Study. Plast Reconstr Surg Glob Open. 2021;9(12):e3973. https://doi.org/10.1097/GOX.0000000000003973
24. Ghatge AS, Ghatge SB. The Effectiveness of Injectable Hyaluronic Acid in the Improvement of the Facial Skin Quality: A Systematic Review. Clin Cosmet Investig Dermatol. 2023;16:891-899. https://doi.org/10.2147/CCID.S404248
25. Yi KH, Winayanuwattikun W, Kim SY, Wan J, Vachatimanont V, Putri AI, Hidajat IJ, Yogya Y, Pamela R. Skin boosters: Definitions and varied classifications. Skin Res Technol. 2024;30(3):e13627. https://doi.org/10.1111/srt.13627
26. Litwiniuk M, Krejner A, Speyrer MS, Gauto AR, Grzela T. Hyaluronic Acid in Inflammation and Tissue Regeneration. Wounds. 2016;28(3):78-88. PMID: 26978861.
27. Lan RT, Ren Y, Wei X, Tang LZ, Shah NA, Xu L, Huang SS, Gul RM, Xu JZ, Li ZM. Synergy between vitamin E and D-sorbitol in enhancing oxidation stability of highly crosslinked ultrahigh molecular weight polyethylene. Acta Biomater. 2021;134:302-312. https://doi.org/10.1016/j.actbio.2021.07.041
Источник
прочитано
2001
раз